Oncology
Cancérologie
Publié le 16 Jan 2023Lecture 8 min
Du nouveau en chimioprévention du cancer du sein ?
Eriksson M, Eklund M, Borgquist S et al. Low-dose tamoxifen for mammographic density reduction: a randomized controlled trial. J Clin Oncol 2021 ; 39 : 1899-908.
Les travaux menés en vue de développer une molécule qui serait efficace pour prévenir la survenue d’un cancer du sein tout en étant dénuée d’effets secondaires restent à ce jour infructueux. Les agents testés jusqu’à maintenant, en particulier le tamoxifène, n’ont pas répondu à la deuxième partie de ce cahier des charges.
La quête en vue de voir émerger une prévention primaire continue donc, et les recherches s’orientent selon deux directions aux philosophies bien différentes. L’une est l’optimisation de l’uti- lisation des agents pharmacologiques disponibles. L’autre propose de privilégier un style de vie plus sain.
Tamoxifène : une longue saga
À la fin des années 1960, les chimistes synthétisent un anti-estrogène, le tamoxifène. Les premières investigations se proposent de mettre à profit les propriétés anti-estrogéniques du composé pour le développer comme contraceptif du lendemain. Echec : il s’avère au contraire inducteur de l’ovulation... La piste est abandonnée. Mais bientôt le tamoxifène trouve sa place dans l’arsenal thérapeutique. Son efficacité est démontrée dans le traitement adjuvant des cancers du sein, en particulier hormono-sensibles. L’administration de tamoxifène permet la diminution du taux des récidives à distance, des récidives locales et de l’apparition de cancers controlatéraux. Ce résultat conduit logiquement à explorer la piste de son utilisation dans une nouvelle indication la prévention primaire.
Anti-estrogènes et prévention primaire
Plusieurs études montrent que les anti-estrogènes s’avèrent efficaces dans cette indication, qu’il s’agisse de SERM (tamoxifène, raloxifène) ou d’inhibiteurs d’aromatase (exémestane, anastrozole, létrozole).
Une métaanalyse portant sur près de 30 000 femmes, publiée en 2019, synthétise les résultats obtenus. La prise de tamoxifène à la dose de 20 mg/jour pendant 5 ans, chez des femmes identifiées comme ayant un risque élevé de développer un cancer du sein, s’accompagne d’une diminution d’incidence de cancers de plus de 30 %.
Le raloxifène, prescrit à des femmes ménopausées, sélectionnées sur un haut risque osseux ou cardiovasculaire, et pris pendant 4-8 ans, diminue le taux de cancers invasifs du sein récepteurs hormonaux positifs de près de 60 %.
Malgré cette efficacité démontrée, le taux de recours à la chimioprévention reste faible, même aux états-Unis, où l’indication est reconnue : le taux d’initiation des prescriptions est bas et la compliance des patientes est mauvaise.
Raison majeure de cette désaffection : une balance bénéfice/ risque insuffisante du fait d’effets secondaires notables. Certes, la prise d’anti-estrogènes s’accompagne d’une diminution d’incidence des tumeurs, mais le taux de complications graves approche le bénéfice en termes du nombre de tumeurs évitées (tableau). Par ailleurs, les tumeurs évitées sont essentiellement de type récepteur hormonal positif. Or ce sont les plus accessibles au traitement. Si bien que, au total, il n’a pas été démontré de baisse de la mortalité. Cela vaut pour le tamoxifène, mais aussi pour les autres anti-estrogènes testés dans l’indication.
En attendant la mise au point de molécules dotées d’un meilleur ratio bénéfice/risque, une des pistes d’investigation proposées est de tester l’utilisation des anti-estrogènes actuellement dispo- nibles, mais en utilisant une posologie plus basse.
Rationnel du tamoxifène à dose réduite
L’intérêt d’utiliser du tamoxifène à dose réduite a été démontré dans une étude préliminaire, publiée en 2019. Il s’agit d’un essai de prévention secondaire chez des femmes traitées pour un carcinome in situ. Le protocole d’étude consiste en la prise de tamoxifène à la dose quotidienne de 5 mg pendant 3 ans. Comparée à un bras placebo, la prise de tamoxifène permet d’observer une diminution des récidives locales (carcinome in situ ou invasif) de 50 % et celle de cancers du sein controlatéraux de 75 %. Avec cette posologie réduite, le profil d’effets secondaires dans le groupe traité est proche de celui observé dans le groupe placebo. La conjonction d’une efficacité maintenue et d’effets secondaires réduits est à la base de l’essai présenté ici.
Prévention primaire et dose minimale efficace
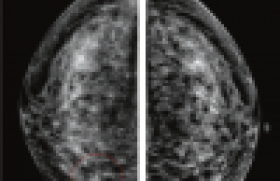
L’investigation menée par Mikael Eriksson et coll. vise à rechercher la posologie minimale efficace de tamoxifène en prévention primaire. Dans cette étude, le comparateur est la dose habituelle de 20 mg/jour. Pour permettre un délai d’analyse suffisamment court, le critère d’efficacité choisi n’est pas le taux d’évènements carcinologiques, mais un critère intermédiaire (un proxy) : la densité mammaire radiographique. Il s’agit d’un paramètre dont la relation avec la cancérogenèse est démontrée (encadré 1). Le protocole de l’étude est présenté dans l’encadré 2.
Résultats sur la densité mammographique
On observe un effet différent selon le statut ménopausique. Chez les femmes non ménopausées, il existe une diminution de la densité moyenne de 18,5 % avec la dose de 20 mg/jour. L’effet est pratiquement aussi intense avec les doses 2,5 mg, 5 mg, et 10 mg/jour. Cependant, la dose de 1 mg/jour a un effet identique à celui du placebo (figure 1, panneau A). Chez les femmes ménopausées, aucune des doses testées, y compris la dose de 20 mg/jour, n’a d’effet (figure 1, panneau B).
Les auteurs ont également évalué les résultats en termes de pourcentage de femmes présentant une réponse positive au tamoxifène. Parmi les femmes ménopausées, aucune ne répond au tamoxifène, même avec la dose de 20 mg/jour. En revanche, dans le groupe des femmes non ménopausées, une réponse significative (c’est-à-dire supérieure à la marge de non-infériorité) est observée chez les femmes ayant pris du tamoxifène à une dose égale ou supérieure à 2,5 mg/jour. Ainsi, 69,7 % des femmes ayant pris du tamoxifène à la dose 2,5 mg/jour sont répondeuses, à comparer avec 63,3 % des femmes ayant pris du tamoxifène à la dose 20 mg/jour (figure 2).
Figure 1. Variation de la densité mammographique en fonction de la posologie de tamoxifène et du statut ménopausique.
Panneau A. Chez les femmes non ménopausées, on observe une diminution de la densité mammographique avec les doses ≥ 2,5 mg/jour.
L’effet de la dose 1 mg/jour ne diffère pas de celui du placebo.
Panneau B. Chez les femmes ménopausées, aucune dose n’a d’effet sur la densité mammographique, y compris la dose standard de 20 mg/jour.
Figure 2. Pourcentage de femmes chez lesquelles on observe une baisse de la densité mammographique ≥ 10 %
en fonction de la posologie quotidienne de tamoxifène.
Chez les femmes non ménopausées, on observe une baisse de la densité mammographique supérieure
à la marge de non-infériorité pour les posologies ≥ 2,5 mg/jour.
Effets secondaires
Le taux de survenue d’effets secondaires sévères varie selon la posologie, mais aussi selon les symptômes analysés. L’effet sur la survenue de symptômes vasomoteurs est proportionnel à la posologie. Avec l’administration de 20 mg/jour, 34 % des femmes se plaignent de symptômes vasomoteurs sévères. Ce pourcentage diminue parallèlement à la diminution de la dose. Il est de 14 % avec le placebo (figure 3). La dépendance à la dose est faible pour le taux de survenue des symptômes gynécologiques et des troubles fonctionnels sexuels sévères, et absent pour les troubles musculo-squelettiques (figure 3). Le taux d’effets secondaires ne dépend pas du statut ménopausique. Le taux de sortie d’essai ne paraît pas influencé par la posologie.
Figure 3. Taux de survenue d’effets secondaires sévères selon la posologie quotidienne de tamoxifène.
Le taux de survenue de symptômes vasomoteurs sévères est dose-dépendant,
alors qu’il est constant pour les troubles musculo-squelettiques.
Le profil d’évolution du taux de troubles fonctionnels sexuels sévères est intermédiaire.
Synthèse
Dans cette étude, l’efficacité du tamoxifène sur la densité mammaire est démontrée pour les femmes non ménopausées. Dans ce groupe, à la posologie de 2,5 mg/jour, il a une efficacité qui n’est pas inférieure à la posologie standard de 20 mg/jour. Cette dose paraît représenter un seuil, puisque la dose de 1 mg/jour n’est pas efficace. Avec la posologie quotidienne de 2,5 mg, le taux de femmes se plaignant de troubles vasomoteurs sévères est diminué d’environ 50 %. Cependant, le taux de survenue des autres symptômes (symptômes gynécologiques, troubles fonctionnels sexuels et troubles musculo-squelettiques) reste globalement inchangé. La diminution de posologie ne paraît donc pas résoudre le problème de l’acceptabilité du tamoxifène en tant qu’agent de prévention primaire.
En outre, un point doit être éclairci. Dans l’étude, le tamoxifène est dénué d’effet sur la densité mammaire chez les femmes ménopausées, même à la posologie de 20 mg. Cette observation a déjà été faite précédemment. Elle contraste avec l’efficacité du tamoxifène en prévention secondaire, qui est démontrée y compris chez les femmes ménopausées. Cette constatation ne reçoit pas d’explication. Elle interroge en tout cas sur la validité de la diminution de la densité mammographique en tant que critère intermédiaire.
Quelle alternative ?
En attendant le développement de nouvelles découvertes pharmacologiques, différentes publications insistent sur le bénéfice apporté par la modification de facteurs qualifiés de modifiables, car liés au mode de vie des sujets. Cette solution présente de nombreux avantages. Non seulement elle est dénuée d’effets secondaires, mais elle présente des bénéfices collatéraux, cardiovasculaires en particulier. Les femmes qui pratiquent une activité physique, sportive ou de loisir, ont un risque de cancer du sein diminué d’environ 20 % (ce chiffre est en fait extrêmement variable selon le type d’activité pris en compte). Les régimes pauvres en graisses, en aliments sucrés, en viandes transformées s’accompagnent d’un risque relatif abaissé d’environ 10 %. À l’inverse, la consommation régulière d’alcool s’accompagne d’un risque accru de cancer du sein (le risque est augmenté de 10 % par dose quotidienne, soit 10 g). Le fait de privilégier un régime riche en fruits et légumes, d’absorber des antioxydants comme les vitamines A, C, ou E ou des caroténoïdes n’a pas d’effet démontré.
Les relations entre risque de cancer du sein et adiposité (cette dernière représentée par l’index de masse corporelle [IMC]) sont en fait complexes. L’obésité dans l’enfance est associée à un risque diminué de cancer du sein, alors qu’un IMC élevé à l’âge adulte est au contraire associé à un risque plus élevé. Plus précisément, c’est l’augmentation de poids avec l’avancée en âge qui s’accompagne d’une augmentation du risque.
Obstacle majeur présenté par le respect de ces règles hygiéno-diététiques : il s’agit d’une solution astreignante...
Il est possible qu’à l’avenir, le développement de tests génétiques, portant sur les mutations géniques et les scores polygéniques, permette de mieux définir des groupes à très haut risque, aboutissant à modifier la balance bénéfice/risque de la chimio-prévention.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :