Obstetric imaging
Imagerie
Publié le 29 Apr 2025Lecture 8 min
FAV, MAV, RPOC, EMV, RTH : de quoi parle-t-on ? Quelle prise en charge en cas de rétention trophoblastique hypervascularisée ?
Hélène FLYE SAINTE MARIE(a)* , Sami EL RAMADAN(a) , Camille PESTRE(a) , Martin EIDESHEIM(b)* , Zacharie SABRI (a)*, Phuong Lien TRAN(a)*
Le terme de « malformation arterio-veineuse utérine» (MAV) est très fréquemment utilisé en première intention devant une hypervascularisation myométriale, mais il s’agit cependant d’une erreur de sémantique.
Rappel des définitions
Le terme de « malformation arterio-veineuse utérine» (MAV) est très fréquemment utilisé en première intention devant une hypervascularisation myométriale, mais il s’agit cependant d’une erreur de sémantique.
Les MAV tout comme les FAV (fistule artério veineuse) appartiennent à la classification des anomalies vasculaires (Société internationale d’étude des anomalies vasculaires[ISSVA] 2014/2018). Elles sont décrites comme des malformations vasculaires congénitales à flux rapide. Leur caractère congénital en fait des entités rares avec une prévalence de 1,5% pour une localisation extra-spinale de 5 à 10 %(1,2).
Une nouvelle définition en 2004 par Van Schoubroeck D et coll.(3) est venue renommer le terme de «MAV acquise utérine» en EMV (Enhanced Myométrial Vascularity), initialement décrite dans un contexte de terminaison de grossesse. En 2015, l’Internationale Society of Ultrasound in Obstetrics(ISUOG) a validé cette notion d’EMV, étendue à toute hypervascularisation myométriale avec ou sans rétention trophoblastique ou placentaire. Un RPOC (Retained Product Of Conception) est défini quant à lui comme l’absence de détachement des résidus trophoblastiques ou placentaires avec, à l’histologie, la présence de villosités choriales en doigt de gant ou de tissus trophoblastiques.
Il persiste encore une confusion dans la littérature, car certains auteurs utilisent le termed’«EMV» devant une hypervascularisation myométriale associée de manière systématique à un RPOC. Cependant, il peut également exister un aspect d’EMV échographique en dehors de tout contexte de terminaison de grossesse, comme dans les suites d’un curetage ou d’une chirurgie utérine où le mécanisme lésionnel vient mettre en communication de manière anormale une artère et une veine myométriale. Par ailleurs le terme de «RPOC» ne contient pas de composante vasculaire stricto sensu et peut être confiné à l’endomètre sans vascularisation : type 0 décrit par Kamaya et coll. en 2009(4).
Pour résumer on peut avoir une EMV sans RPOC et un RPOC sans EMV…
Nous avons fait le choix de retenir le terme de «rétention trophoblastique hypervascularisée» (RTH) devant une EMV associée à un RPOC, car il associe à la fois la composante vasculaire et rétentionnelle. Il s’agit de la présentation clinique que vous rencontrerez le plus souvent au cours de vos examens échographiques.
L’élément commun «vasculaire» à toutes ces entités est le shunt artério-veineux, une communication anormale entre veines et artères généralement à haut débit.
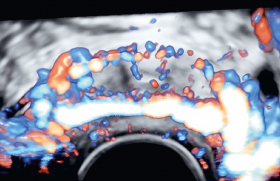
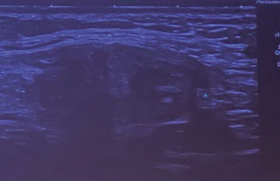
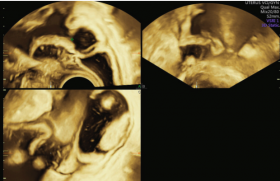
La figure 1 reprend l’ensemble des étiologies des EMV ayant en commun un shunt artério-veineux. Cet EMV apparaît en échographie 2D sous la forme de structures vasculaires hypoéchogènes, tortueuses intramyométriales plus ou moins extensives(figure 2).
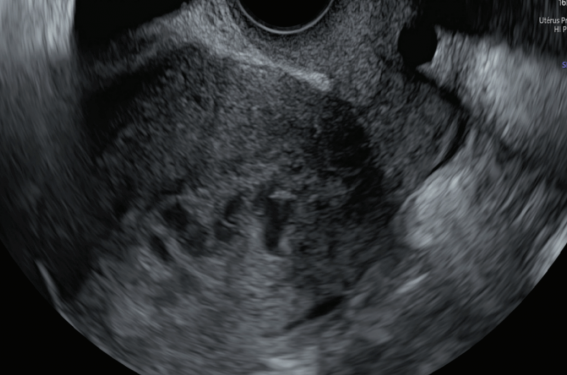
La clé du diagnostic reposera sur l’analyse du Doppler couleur : hypervascularisation myométriale avec de nombreuses zones d’aliasing (mosaïque de couleurs) avec étude du shunt artério-veineux à haut débit en mode pulsé en augmentant la PRF (Pulse Repetition Frequency) pour recruter les flux à haute vélocité (figure 3).
On s’attachera à faire une description de la taille et de l’envahissement de cette hypervascularisation myométriale, de la zone de jonction endomètre-myomètre et de la présence ou non d’une rétention (trophoblastique ou placentaire) associée.
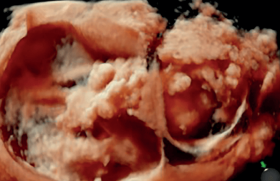
En cas de rétention : épaisseur endométriale ˃ 10 mm voire 13-15 mm, perte de la ligne de vacuité avec rupture de zone de jonction endomètre-myomètre, aspect d’une masse focalisée, hétérogène, le plus souvent hyperéchogène (figure 4).
Figure 1. Classification des EMV.
Figure 2. EMV en mode 2D.
Figure 3. Zone aliasing , analyse Doppler pulsé sur la zone d’EMV.
Figure 4. Rétention trophoblastique.
Quelle prise en charge des rétentions trophoblastiques hypervascularisées (RTH) ?
Nous retiendrons donc comme définition des RTH une EMV associée à une absence de détachement des résidus trophoblastiques ou placentaires(Retained Product Of Conception [ROPC]). Leur prévalence varie de 1,5 à 6,3 %(5,6).
Il s’agit de l’entité la plus courante que vous pourrez rencontrer devant la présence d’une hypervascularisation myométriale. Elle reste à ce jour une source de stress pour les équipes médicales et les patientes, car trop longtemps confondue et associée aux MAV. L’enjeu de notre expertise échographique est d’essayer de définir le risque hémorragique si l’on décide de réaliser une procédure chirurgicale (curetage) ou le risque d’hémorragie secondaire en cas d’attitude expectative.
Le risque de saignement est naturellement corrélé à la présence d’un shunt artério-veineux à haut débit ; Signe direct : zone aliasing avec des vitesses de circulation rapides, pic de vitesse systolique (PSV) très élevé, index de résistance (IR) ≤ 5 au niveau des artères utérines.
Certains auteurs ont essayé de définir une valeur seuil PSV ainsi que d’autres éléments échographiques et cliniques prédictifs du risque hémorragique du shunt arterioveineux «acquis» dans les RPOC mais tous sur de faibles effectifs.
• Le PSV (pic de vitesse systolique) (figure 5)
Timmermanet coll.(7) avaient étudié en 2004 la valeur prédictive d’une prise en charge invasive selon la PSV mesurée au sein de la lésion. Les patientes présentant des PSV > 0,83/s étaient plus à risque de nécessiter un traitement par embolisation. Inversement, aucune RTH qui présentait des PSV < 0,39 m/s n’avait été traitée par un geste invasif (cohorte de 30 patientes) (figure 6)
Timor-Tritsch et coll. (8) quant à eux concluaient que les RTH avec une PSV ≤ 40 cm/s étaient susceptibles de régresser spontanément alors que pour une PSV> 60 cm/s le risque hémorragique et interventionnel était plus élevé (cohorte de 25 patientes)
Figure 5. Analyse du Doppler pulsé.
Figure 6. Risque hémorragique selon le PSV.
• La profondeur d’infiltration de la vascularisation
SelonAkiba et coll.(9) le risque d’hémorragie secondaire était corrélé à la profondeur de l’infiltration myométriale de la lésion vasculaire (cohorte de 19 patientes)(figure 7).
• Taille de la lésion vasculaire (figure 8)
Le risque d’hémorragie génitale secondaire serait également corrélé à la taille de la lésion vasculaire avec un risque faible lors de procédure invasive (curetage aspiratif) pour des lésions ≤ 30 mm(9) voire ≤ 44 mm(10).
• Contexte clinique
Le délai par rapport à la terminaison de la grossesse aurait également une importance pour évaluer le risque de saignement. Des EMV persistant jusqu’à 6 semaines après l’accouchement peuvent correspondre à des involutions physiologiques du lit placentaire et ne doivent pas être considérées comme anormales en dehors des saignements. En revanche, la présence de cette hypervascularisation myométriale au-delà de 10 semaines du post-partum est considérée par certains auteurs comme pathologique(11).
La persistance d’une RTH serait responsable d’une majoration progressive des shunts AV en regard de la zone d’insertion trophoblastique/placentaire(12).
Figure 7. Risque hémorragique selon l’infiltration myométriale d’après Akiba(9).
Figure 8. Taille de la lésion vasculaire.
Figure 9. Arbre décisionnel pour la prise en charge d’une rétention trophoblastique hypervascularisée.
Application des données de la littérature dans un algorithme de prise en charge des RTH
Le stress engendré parla confusion MAV et RTH nous a amenés à établir, avec les radiologues interventionnels de notre équipe, un arbre décisionnel afin de guider les praticiens du CHU Sud-Réunion dans la prise en charge de ces entités. Même si l’ensemble des paramètres décrits précédemment s’appliquaient à de faibles cohortes, nous avons fait le choix de les intégrer à notre algorithme, car il n’existait aucun consensus pour la prise en charge de ces lésions.
À noter que nous avons également pris en compte les antécédents gynéco-obstétricaux pouvant faire suspecter une « implantation pathologique » (gestes endo-utérins répétés, chirurgie utérine, etc.), car supposés à risque surajouté de saignements secondaires.
La valeur du PSV a souvent été discutée comme peu discriminante du risque hémorragique dans la littérature(13-15), et l’équipe deT immerman a récemment conclu qu’il ne fallait plus l’intégrer dans la prise en charge des RTH car à risque de surtraitement par embolisation(16).
Nous avons cependant souhaité garder son évaluation dans notre démarche diagnostique et thérapeutique car elle permet de dépister facilement un shunt AV à haut débit et de privilégier une attitude expectative pour les patientes avec des vitesses faibles. En cas de valeur élevée du PSV nous proposons la réalisation d’une angio-IRM afin de conclure à la présence ou non d’un shunt arterio-veineux à haut débit avec un retour veineux anormal avant d’aller directement à l’embolisation. Le terme «MAV» est encore souvent employé dans les équipes devant une RTH en première intention, et nous espérons que cet algorithme pourra aider à mieux comprendre sa présentation clinique et à individualiser la prise en charge. Nous avons appliqué cet arbre décisionnel à notre population réunionnaise et nous espérons vous proposer prochainement une version remaniée et améliorée, permettant une meilleure prédiction du risque de saignement pour les RTH.
* a. Centre hospitalier universitaire Sud-Réunion, Saint-Pierre, La Réunion
b. Département d’anesthésie-réanimation et de médecine périopératoire de Brabois, CHRU Nancy
1. Eifert S et al. Prevalence of deep venous anomaliesin congenital vascular malformations of venous predominance. J Vasc Surg 2000 ; 31(3) : 462-71.
2. TasnádiG. Epidemiology and etiology of congenital vascular malformations. Semin Vasc Surg 1993 ; 6(4) : 200-3.
3. Van Schoubroeck D et al. Prospective evaluation of blood flow in the myometriumand uterine arteriesin the puerperium. Ultrasound Obstet Gynecol 2004 ; 23(4) : 378-81.
4. Kamaya et al. Retained products of conception :spectrum of color Doppler findings.JUltrasound Med 2009 ; 28(8): 1031-41.
5. Grewal K et al. Natural history of pregnancy-relatedenhancedmyometrial vascularityfollowingmiscarriage.Ultrasound ObstetGynecol 2020 ; 55(5): 676-82.
6. Van den Bosch T et al. Occurrence and outcome of residual trophoblastic tissue :Aprospective study.JUltrasound Med 2008 ; 27(3) : 357-61.
7. Timmerman et al. Ultrasound Obstet Gynecol 2004.
8. Timor-Tritsch IE et al.Ultrasound diagnosis and management of acquired uterine enhanced myometrial vascularity/arteriovenous malformations. Am J Obstet Gynecol 2016; 214(6) : 731.e1-731.e10.
9. AkibaNet al.Ultrasonographic vascularity assessment for predicting future severe hemorrhage in retained products of conceptionaftersecond-trimesterabortion.JMaternFetalNeonatalMed2021 ; 34(4) : 562-8.
10. Kobayashi M et al. The RPOC long axis is a simple indicator for predicting the need ofinvasive strategiesforsecondary postpartum hemorrhage in either post-abortion or post-partum women: a retrospective case controlstudy. BMC Pregnancy Childbirth 2021 ; 21(1) : 653.
11. van SchoubroeckDet al. Prospective evaluation of blood flow in themyometrium and uterine arteries in the puerperium.UltrasoundObstetGynecol2004; 23(4) : 378-381.
12. Bazeries P et al.UterineArtery Embolization for Retained Products of Conception with Marked Vascularity:ASafe and Efficient First-Line Treatment. Cardiovasc Intervent Radiol 2017 ; 40(4) : 520-9.
13. Grewal K et al. Natural history of pregnancy-related enhanced myometrial vascularityfollowingmiscarriage.Ultrasound ObstetGynecol2020;55(5):676-82.
14. van den Bosch T et al. maximum peak systolic velocity and management of highly vascularized retained products of conception. J Ultrasound Med 2015 ; 34(9) : 1577-82.
15. Groszmann YS et al. Diagnosis and management of patients with enhanced myometrial vascularity associated with retainedproductsofconception.Ultrasound ObstetGynecol 2018 ; 52(3): 396-9.
16. DewildeKetal.Enhancedmyometrial vascularity secondary to retained pregnancy tissue : time to stop misusing the termarteriovenousmalformation.Ultrasound Obstet Gynecol 2024 ; 63(1) : 5-8.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :