Imagerie fœtale
Recherche
Publié le 16 avr 2019Lecture 9 min
Nouvelle imagerie tridimensionnelle embryofœtale par immunomarquage
Présentée par Gérard COULY, Travail de Institut de la Vision, INSERM UMRS 968, Paris
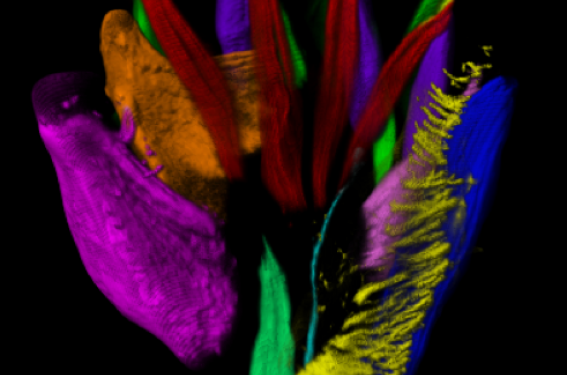
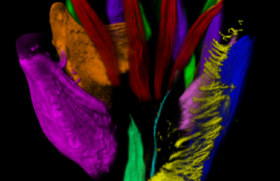
Le groupe de travail de l’Institut de la Vision dirigé par A Chedotal (UCPM, INSERM UMRS 968, Paris 6 Sorbonne) a publié dans la revue Cell en 2017(1) l’imagerie de nombreuses structures organiques en développement de l’embryon et du fœtus, objectivées par immunomarquage, de la fin du 1er trimestre au début du 2e, entre les 6e et 12e semaines post-conceptionnelles (SPC), ou de la 8e à la 14e SA.
Les images obtenues en haute définition, puis reconstruites en 3D, ont permis d’établir la cartographie cellulaire et moléculaire et de documenter le développement de l’embryon humain et son devenir fœtal précoce.
Cette analyse morphologique nouvelle par immunomarquage éclaire l’anatomie du développement sur une période jusqu’ici peu documentée, c’est-à-dire à la fin de l’organogenèse, et constitue l’étape préalable et essentielle à la reconnaissance organique normale et pathologique recherchée lors de l’échographie anténatale.
Matériel et méthodes(1)
Les 36 embryons (n = 7) et fœtus (n = 29) étudiés et analysés ont été collectés par des Institutions qui ont assuré les obligations réglementaires telles que le consentement, l’éthique, les prélèvements, les fixations embryonnaires et fœtales, ainsi que le recueil des données génomiques et phénotypiques majeures.
Les âges et sexes des spécimens ont été déterminés avant fixation et ceux-ci ont été traités en immunohistochimie par anticorps primaires et secondaires, au nombre de 19, dirigés contre les épitopes spécifiques des cellules à phénotype déjà exprimé. Parmi les anticorps utilisés pour l’immunomarquage nous citons :
– Peripherin, dirigé contre la protéine des filaments des neurones du système nerveux périphérique sensitivo-sensoriel ;
– Tag 1, dirigé contre les fibres nerveuses sensitivo-sensorielles ;
– les antimyosines du muscle strié et les antimyosines des muscles lisses dirigées contre la musculature lisse des parois vasculaires ;
– Choline acétyl-transférase reconnaissant les nerfs moteurs ;
– Anticorps contre la protéine SOX10 et SOX2 pour la reconnaissance des cellules de Schwann des nerfs sensoriels ;
– Anticorps dirigés contre la protéine PLVAP marquant les endothélia des vaisseaux.
Les cellules constitutives d’organes en développement immuno-marquées sont ainsi identifiées en fonction de leurs phénotypes.
L’acquisition des images a été obtenue par ultramicroscopie à fluorescence à feuille de lumière travaillant de manière stratigraphique en coupes virtuelles de 3 microns et reconstruites en 3D, avec ainsi conservation éternelle de l’échantillon.
Cette procédure a permis d’objectiver les volumes organiques, mais aussi les architectures nerveuse, musculaire, et vasculaire interne des organes à un stade précoce, ainsi que l’agencement cellulaire à haute résolution quand cela fut nécessaire.
Les domaines embryofœtaux en développement suivants ont été explorés et visualisés en 3D :
– le système cardio-pulmonaire ;
– le système nerveux périphérique ;
– le système nerveux central ;
– les muscles somatiques ;
– l’appareil génito-urinaire ;
– le système vasculaire ;
– l’appareil digestif.
Résultats
L’imagerie obtenue en haute résolution concerne le développement de nombreux organes et systèmes organiques.
Précocité de la détermination phénotypique et anatomique des organes
Cette imagerie a révélé la précocité, dès la fin du premier trimestre de gestation, de l’établissement des phénotypes cellulaires et des constructions organiques. Celles-ci nous sont apparues telles des miniatures ou des modèles réduits des futurs organes que l’on observe chez l’adulte. Nous ne connaissons pas à l’heure actuelle le ou les facteurs moléculaires qui président à la croissance organique embryofœtale à partir de la fin de l’organogenèse. Mais cette précocité organogénétique pourrait avoir comme applications, et justifier, la possibilité du diagnostic précoce dès la fin du premier trimestre — vers 12 SA — de nombreuses dysmorphologies. Ceci est démonstratif en particulier pour le cœur, le corps de l’embryon et ses extrémités (figures 1 à 5).
Figure 1a : Le cœur embryofœtal à 9 SPC, 11 SA. Son anatomie tant externe qu’interne, vasculaire et nerveuse, est totalement établie. Remarquez l’échelle. À ce stade, le cœur mesure 3 000 microns x 3 000 microns x 4 000 microns.
Figure 1b.
Figure 2a : Le corps de l’embryon à 8 SPC, 10 SA. La préparation en vue postérieure de ¾ gauche objective le cerveau postérieur (tronc cérébral et 4e ventricule), la moelle épinière et les émergences nerveuses, dont les destinées sont la tête, le thorax et les membres supérieurs.
Figure 2b : Le corps de l’embryon à 8 SPC, 10 SA. La préparation objective la moitié supérieure du corps (squelette et muscles).
Figure 3a : La main gauche à 9,5 SPC. L’intégralité de la musculature thénarienne et hypothénarienne, ainsi que les muscles interosseux et lombricaux en vue dorsale et ventrale, sont objectivés et identifiés selon une couleur différente. (Immunomarquage par anti-myosine).
Figure 3b.
Figure 4 : Le pied gauche à 9,5 SPC et ses nerfs, en immunomarquage par choline acétyl-transférase et Tag 1 révélant les nerfs moteurs et sensitifs en 3D.
Figure 5a : Le tronc cérébral et ses nerfs à 7,5 SPC. Tête et cou de profil d’embryon humain objectivant les nerfs crâniens III à XII issus du tronc cérébral et les racines cervicales à destinée faciale et cervicale par immunomarquage avec Tag 1 et Peripherin en 3D. Remarquer la précocité et la densité nerveuses à destinée oro-faciale et cervicale de l’ébauche embryonnaire à ce stade. L’embryon devenu fœtus à 10 SPC (12 SA) commence à sucer et déglutir grâce à l’organisation neurologique du tronc cérébral et de ses nerfs.
Figure 5b : Le tronc cérébral et ses nerfs à 7,5 SPC. L’embryon de face au même âge.
Précocité organogénétique et activité fonctionnelle embryo-fœtale
La précocité de l’organogenèse accomplie et la densité du système nerveux périphérique concernant en particulier les nerfs du tronc cérébral (III > XII) et leurs ganglions sensoriels à destinée orale, linguale et pharyngolaryngée (figure 5) vers 10 SPC (12 SA) coïncident avec les premières manifestations de l’oralité embryofœtale de succion et de déglutition objectivées en échographie. Ainsi, ces séquences orales comportementales si fondamentales pour l’avenir du fœtus et du nouveau-né ne démentent pas le développement conjoint et de même chronologie de la région du système nerveux central qui en assure la commande neurologique (figure 4). De même, dans ce contexte fonctionnel oral, l’innervation sensitivo-sensorielle et motrice de la langue et de la face ont la même maturité neurologique (figures 5 à 8).
Figure 6 : Innervation céphalique et thoraco-brachiale à 8 SPC en vue de face par immunomarquage par anti-myosine et Tag 1 (I : nerf olfactif ; II : nerf optique).
Figure 7a : Langue de l’embryon à 9,5 SPC (vue de dessus). L’immunomarquage par Choline acéyl-transférase et Tag 1 objective la densité des nerfs moteurs (XII), sensitifs de la sensibilité générale (V, IX), et sensoriels gustatifs (VII bis, et IX) en 3D.
Figure 7b : Langue de l’embryon à 9,5 SPC (vue de face).
Figure 7c : Langue de l’embryon à 9,5 SPC (vue profil).
Dissymétries et variations
Parmi les données obtenues, celles recueillies avant la fin du premier trimestre de gestation — comme l’innervation périphérique embryofœtale précoce des membres et de leurs extrémités — nous sont apparues similaires à celles de l’adulte, mais avec déjà d’importantes dissymétries et des variations intra- et inter-individuelles(1).
Nerfs olfactifs et optiques
Les nerfs olfactifs (I) et optiques avec le chiasma (II) sont bien objectivés à 8 SPC, soit 10 SA, ainsi que les muscles oculomoteurs (figures 8 à 10).
Figure 8 : L’innervation trigéminée du visage fœtal à 8 SPC. Visage de l’embryon humain à 8 SPC. L’immunomarquage avec Tag 1 et anti-myosine révèle la densité neurologique sensitive des nerfs trijumeaux droit et gauche, ainsi que les muscles oculomoteurs droits et gauches en 3D (en rouge).
Figure 9 : Présentation du contenu de l’orbite à 8 SPC avec les muscles oculomoteurs (en rouge), le nerf optique II (flèche verte). I : nerf olfactif au travers de la lamina cribrosa et dans la fosse nasale embryonnaire.
Figure 10 : Le chiasma optique à 8 SPC par immunomarquage en haute résolution par Tag 1, en 3D.
Différenciation sexuelle
La différenciation génitale mâle ou femelle et la détermination du sexe sont apparues d’origine vasculaire.
Discussion
La différenciation cellulaire d’origine génétique au cours du développement est le résultat de la mise en action d’une cascade de facteurs de transcription. Elle détermine des phénotypes cellulaires variés nécessaires à l’élaboration des organes à fonction spécifique, et ainsi des organismes. Ces facteurs de transcription identifiés sont les nouveaux outils d’analyse puis de compréhension de l’étude de la morphogenèse de l’embryon humain.
Dix-neuf anticorps ont été utilisés, dirigés contre ces facteurs de transcription afin de suivre les développements des divers systèmes organiques objectivés et étudiés par immunomarquages.
Cette nouvelle imagerie nous apparaît constituer une avancée indéniable dans l’analyse de l’organogenèse et la dynamique de l’anatomie embryofœtale entre les 6e et 12e SPC, soit entre les 8e et 14e SA, période du développement encore insuffisamment documentée, d’autant que nous sommes en fin d’organogenèse et à la frontière entre étapes embryonnaires et fœtales.
Les échantillons étudiés sont immortalisés par cette méthode d’analyse
Cette méthode répond encore à l’adage du Professeur André Delmas « la mort est utile à la vie ».
Les échographistes du fœtus peuvent consulter le website* en accès libre afin de disposer de l’atlas organogénétique couvrant la fin de la période embryonnaire jusqu’au début de la période fœtale, époque de la mise en action de certaines fonctions, comme l’oralité de succion et déglutition.
L’objectivation des architectures nerveuse, vasculaire, musculaire et organique intimes (comme le poumon) complètera de manière indispensable l’imagerie échographique en permettant des diagnostics organiques de plus en plus précoces.
Malheureusement, cette imagerie évolutive de haute définition, utile pour objectiver le développement embryofœtal précoce, n’est pas encore réalisable in vivo par immunomarquage. Elle le sera dans l’avenir, nous le pensons, quand les progrès de la pharmacologie et de la chimie fœto-maternelles auront permis de résoudre la toxicité des anticorps et leurs effets délétères en permettant leur utilisation sans risque pour la mère et le fœtus.
Dans le futur, un diagnostic précoce
De nombreuses structures embryofœtales sont ainsi construites au stade précoce de 12 SA, et ce de manière complète et finale, mais à une échelle très réduite (organes de quelques millimètres). Ceci autoriserait dans l’avenir la possibilité de faire des diagnostics dysmorphologiques précoces, vers 12 SA, quand sera résolue la toxicité potentielle mentionnée des anticorps utilisés.
Cette possibilité de diagnostic dysmorphologique embryofœtal précoce et précis concernant des structures anatomiques comme les nerfs (chiasma optique, structures cochléovestibulaires, etc.), ou toute autre structure à partir de signes d’appel qu’il conviendra de définir, pourrait déclencher la décision d’IMG à l’âge et au stade où sont pratiquées les IVG.
Ce serait la mise en congruence temporelle de l’IVG et de l’IMG.
Conclusion
Nous présentons l’imagerie originale obtenue par cartographie cellulaire et moléculaire de l'embryon et du fœtus humains du premier trimestre de gestation. Elle est essentielle à la compréhension des mécanismes de l'organogenèse normale et pathologique. La méthode consiste à identifier les organes et leurs tissus constitutifs grâce à leur facteur de transcription, garant de la différenciation cellulaire par immunohistochimie moléculaire spécifique, révélée par son imagerie 3D. La carte cellulaire et organique évolutive obtenue concerne les développements :
– nerveux périphérique et central ;
– cardio-pulmonaire et vasculaire ;
– urogénital ;
– musculaire et des membres.
Chacun des tissus constitutifs est repéré par immunomarquage grâce à des anticorps produits contre les cibles moléculaires cellulaires spécifiques.
Des informations morphologiques nouvelles ont été recueillies, telles que la grande précocité du développement des organes dont l’échelle est forcément réduite, de l'établissement de la métamérie nerveuse et des territoires cutanés ou l'origine vasculaire de la différenciation sexuelle.
Ce travail est précurseur pour l'imagerie embryofœtale précoce du futur. Mais pour le moment, il reste encore très en amont de l'échographie fœtale, dans l'attente des progrès fœtomaternels pharmacologiques permettant l’utilisation de ces anticorps in vivo sans risque.
Morgane Belle1, David Godefroy1, Gérard Couly1, Samuel A. Malone2,3, Francis Collier4,5, Paolo Giacobini2,3,4, Alain Chédotal1
1. Sorbonne Universités, UPMC Univ Paris 06, INSERM, CNRS, Institut de la Vision, INSERM UMRS 968, Paris
2. University of Lille, UMR-S 1172 - JPArc - Centre de Recherche Jean-Pierre AUBERT Neurosciences et Cancer, Lille
3. Inserm, UMR-S 1172, Laboratory of Development and Plasticity of the Neuroendocrine Brain, Lille
4. FHU 1,000 Days for Health, University of Lille, School of Medicine, Lille
*Website : http://www.transparent-human-embryo.com/
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :