Infertility
Research
Publié le 04 Jun 2019Lecture 15 min
Actualités sur le blastocyste
Leslie SITBON SITRUK, BIOMEGA, Assistance Médicale à la Procréation, Centre Hospitalier Intercommunal de Créteil
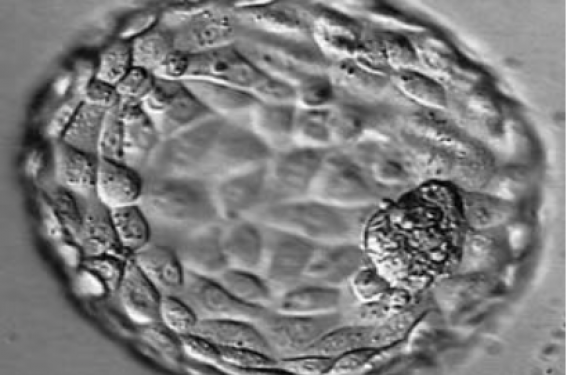
Le blastocyste correspond physiologiquement au dernier stade embryonnaire avant l’implantation.
Théoriquement, après fécondation dans la trompe, l’embryon poursuit son développement tout en parcourant la trompe pour atteindre la cavité utérine vers le 4-5e jour, au stade blastocyste, pour s’y implanter.
À J1 post-fécondation, l’embryon nouvellement formé est au stade zygote et contient 2 pronucléus haploïdes, structures cellulaires correspondant à chacun des deux noyaux, l'un provenant du spermatozoïde, l'autre de l'ovocyte. À la 25e heure post-fécondation, l’embryon amorce sa division cellulaire. Il contient 4 cellules à J2 puis 8 cellules à J3. Au 4e jour il est au stade de morulæ. Il atteint le stade blastocyste au 5e jour puis éclots le 6e jour, avant de s’implanter dans la cavité utérine.
Le blastocyste est formé du blastocèle, de la masse cellulaire interne (MCI) à l’origine du fœtus et du trophectoderme (TE) à l’origine du placenta (figure 1).
Figure 1 : Blastocyste.
In vitro, le blastocyste est évalué selon la classification de Gardner et Schoolcraft (tableaux). Celle-ci attribue 3 scores de qualité selon le stade de développement en blastocyste (statut d’expansion embryonnaire et d’éclosion naturelle) (score de 1 à 6), la qualité de la masse cellulaire interne (score de A à C) et la qualité du trophectoderme (score de A à C) (figures 2 à 9).
De nombreuses études comme celle de Goto et al.(1) montrent qu'en plus de l’âge de la femme, il y a une corrélation significative entre la qualité du blastocyste et le taux de grossesses cliniques, le taux de grossesses évolutives et le taux d'accouchements.
Tableaux : Classification de Gardner et Schoolcraft.
Figure 2 : Blastocyste B1.
Figure 3 : Blastocyste B2BB.
Figure 4 : Blastocyste B2BC.
Figure 5 : Blastocyste B3BB.
Figure 6 : Blastocyste B4AA.
Figure 7 : Blastocyste B4AB.
Figure 8 : Blastocyste B4BB.
Figure 9 : Blastocyste B5.
Le but de l’AMP est d’obtenir une grossesse unique aboutissant à la naissance d’un enfant en bonne santé. Cependant, la difficulté réside dans l’obtention et le choix de l'embryon pouvant arriver à ce résultat optimal. Compte tenu des écueils de la culture embryonnaire, la majorité des centres d'AMP en France transfèrent des embryons clivés J2-J3 en se basant sur de multiples classifications embryonnaires. Ces classifications ont pour but de choisir l'embryon ayant le meilleur potentiel implantatoire. L'embryon clivé était jusqu’à présent considéré comme le meilleur choix pour le transfert, ainsi que pour la congélation embryonnaire, la technique de congélation lente donnant de meilleurs résultats sur les embryons clivés que sur les blastocystes.
Cependant, avec les rapides progrès des milieux de culture et de la vitrification embryonnaire, le transfert et la congélation au stade blastocyste présentent aujourd’hui de nombreux avantages.
En effet, de nombreuses études (Schoolcraft et Gardner(2,3)) ont montré l’intérêt de transférer au stade blastocyste plutôt qu’au stade embryon clivé en termes de taux d’implantation et de taux de grossesse.
En plus de l'amélioration des résultats, la culture prolongée des embryons permettrait une sélection naturelle des embryons, puisqu'elle s’étend après l’activation du génome embryonnaire survenant à J3 : ainsi, les embryons capables de former des blastocystes in vitro correspondraient aux embryons ayant le plus grand potentiel implantatoire (Martins et al.(4)).
En AMP, l’implantation ne dépend pas seulement de la qualité embryonnaire mais également de la réceptivité endométriale. Théoriquement, les blastocystes présenteraient un potentiel implantatoire plus important puisqu’in vivo les embryons atteignent l’utérus environ au 4e jour après la fécondation ; ainsi en AMP, transférer les embryons plus tardivement, en termes d’exposition de l’embryon à l’environnement utérin, reviendrait à l’équivalent d’un cycle naturel. En effet, longtemps considérée comme l'environnement le plus optimal pour les embryons, la cavité utérine pourrait dans certains cas être un environnement hostile. Le taux supra-physiologique en estradiol dû à la stimulation ovarienne augmente les contractions utérines et altère la réceptivité endométriale, associé parfois à une élévation concomitante du taux de progestérone (Fanchin et al.(5)). Le transfert de blastocystes pourrait ainsi prévenir l’exposition prématurée à un environnement utérin hostile.
Malgré des avantages du transfert au stade blastocyste, la culture prolongée présente certains inconvénients. Même si la métaanalyse de Papanikolaou et al.(6) montre un taux de naissances vivantes significativement plus important après le transfert de blastocystes frais comparé au transfert d’embryons clivés, avec un nombre égal d’embryons transférés, ces résultats restent controversés puisque d’autres études (Martins et al., 2017(4)) n’ont pu confirmer cela.
Un autre inconvénient de la culture prolongée serait que l’environnement embryonnaire in vitro avec les milieux de culture serait moins bénéfique que l’environnement in vivo. La culture prolongée après l’activation du génome embryonnaire pourrait a contrario être délétère sur l’embryon et conduit à un échec de blastulation des embryons en culture et donc à une absence de transfert d’embryons qui auraient pu s’implanter s’ils avaient été transférés au stade d’embryons clivés J2/J3. Guérif et al.(7) ont évalué chez les femmes de moins de 36 ans l’efficacité du transfert d’un blastocyste en comparaison avec le transfert de deux embryons clivés. Dans cette étude ils montrent que le taux de transfert est significativement plus bas chez les couples ayant bénéficié d’un transfert d’un seul blastocyste versus ceux ayant été transférés de 2 embryons clivés (88 % versus 100 % respectivement).
Les métaanalyses Cochrane(8) et de Papanikolaou et al.(6) montrent que le transfert de blastocystes est associé, de façon significative, à un taux plus important d’échec de transfert du fait d'un échec de blastulation et une diminution du taux d’embryons congelés, par rapport aux embryons clivés. Papanikolaou a analysé les résultats de 8 études sur cette donnée : le taux d'échec de culture et donc d'absence de transfert est d'environ 9,5 % dans le groupe blastocyste versus 4,3 % dans le groupe embryons clivés.
Une augmentation de la durée de la culture correspond à une augmentation de la charge de travail au laboratoire.
Revue de la littérature : état des lieux
Aux regards des avantages et inconvénients de la culture prolongée, cet état des lieux des connaissances sur le blastocyste va permettre de mettre en balance le bénéfice et le risque de cette technique dans le but d’adapter nos pratiques quotidiennes en AMP.
Amélioration des méthodes de culture
De nombreuses variables impactent le succès d’une tentative d’AMP. Transférer un embryon euploïde est le résultat d’un système complexe qui requiert de nombreuses étapes préalables. La culture embryonnaire et les manipulations de l’embryon au laboratoire peuvent impacter son potentiel implantatoire. Les facteurs de stress environnementaux dus aux milieux de culture et aux conditions de culture peuvent avoir un impact biochimique, métabolique et épigénétique (Swain et al.(9)). C’est la raison pour laquelle une perpétuelle amélioration des connaissances permet une amélioration des milieux de culture afin d’optimiser le développement embryonnaire jusqu’au stade blastocyste et d'augmenter le nombre d’embryons de bonne qualité.
In vivo, les embryons sont exposés à des concentrations d’oxygène de 2 % à 8 %. La culture embryonnaire in vitro, en utilisant des taux d’oxygène à la pression atmosphérique, altère le métabolisme des embryons et le développement en blastocystes dans de nombreuses espèces animales. Ainsi, de meilleurs taux de naissances après transfert de blastocyste ont pu être obtenus en abaissant la concentration en oxygène dans les incubateurs (Wale et al.(10); Calzi et al.(11)).
La culture prolongée des embryons jusqu'au stade blastocyste devrait donc être réalisée en hypoxie, d'où la nécessité d'avoir dans le laboratoire du matériel adéquat, c'est-à-dire des étuves tri-gaz permettant l'obtention d'une diminution de la concentration en oxygène.
Politique d’eSET
Bien que la première grossesse après FIV soit survenue après le transfert d’un seul embryon, cette pratique de ne transférer qu’un embryon a très vite été remplacée par le transfert de plusieurs embryons, qui permettait l’obtention d’un taux de grossesses plus important. Cependant, cette augmentation s'est accompagnée d’une augmentation du taux de grossesses multiples. La politique de transfert d’un seul embryon (eSET) a donc été évoquée comme une stratégie pour réduire le taux de grossesses multiples après AMP.
L’étude de Zander et al.(12) montre que de différer le transfert au stade blastocyste plutôt que de transférer au traditionnel stade clivé permet une meilleure sélection de l’embryon ayant le plus de chance de s’implanter, en maximisant les chances de grossesse, même avec le transfert d’un seul embryon. Cette politique d’eSET au stade blastocyste peut donc réduire le taux de grossesses gémellaires tout en maintenant un taux d’accouchements proche de celui d’un transfert de deux embryons clivés.
Une étude prospective randomisée contrôlée menée par Papanikolaou en 2006(13) a eu pour but de déterminer s’il existe des différences dans les taux de grossesse et d’accouchement entre les femmes ayant un transfert d’un embryon clivé J3 et les femmes ayant un transfert d’un blastocyste J5. Elle montre une augmentation significative du taux de grossesses dans le groupe blastocyste. Le taux d’accouchements est significativement plus important dans le groupe blastocyste.
Le transfert au stade blastocyste augmente donc le taux de grossesse par embryon transféré, ce qui est particulièrement pertinent dans un contexte de politique d’eSET dans le but de réduire les grossesses multiples.
Amélioration des résultats
Une récente métaanalyse Cochrane de 2016(8) montre que les transferts de blastocystes ont des taux de grossesses cliniques et de naissances vivantes plus importants comparés aux transferts d’embryons clivés frais. Cependant, le biais fondamental de nombreuses études analysées dans cette métaanalyse était d’inclure des groupes de patientes ayant eu un nombre inégal d’embryons transférés, avec plus d’embryons transférés au stade clivé qu'au stade blastocyste.
La métaanalyse de Papanikolaou et al.(6) a ainsi comparé des études dont le critère d’inclusion principal était un nombre d’embryons transférés égal dans le groupe transfert de blastocyste et le groupe transfert d’embryon clivé. Elle montre une augmentation significative du taux de naissances vivantes et du taux de grossesses cliniques lors de transferts de blastocystes.
Néanmoins le biais important de ces études est qu'elles rapportent des résultats seulement en transfert frais, alors que seul le taux cumulé de grossesse incluant les transferts frais et congelés reflète les résultats d’un cycle.
Congélation embryonnaire et taux cumulé de grossesses
L’introduction de la vitrification comme technique de congélation a révolutionné les taux de survie des embryons cryoconservés et amélioré les taux de grossesse. Ainsi, le principal indicateur pour comparer les blastocystes et les embryons clivés devrait être le taux cumulé de grossesses.
Une première étude en 2013 (Zhu et al.(14)) montre une augmentation significative du taux de grossesse par cycle et par transfert et du taux d’implantation dès le premier cycle de transfert d’embryon congelé lors de transferts de blastocystes par rapport aux embryons clivés. Cependant, le taux cumulé de grossesses est similaire dans les 2 groupes.
L’étude de De Vos et al.(15) en 2016 confirme que le taux de naissances vivantes par cycle est significativement plus important après le transfert d’un blastocyste frais. De même, le taux cumulé de grossesses est identique après transfert de blastocystes ou d’embryons clivés, mais la grossesse est obtenue plus rapidement après transfert de blastocystes, car le nombre d’embryons nécessaires pour obtenir une grossesse est significativement moins important pour les blastocystes.
L’étude de Carvalho et al.(16) en 2017 et de Guérif et al.(17) en 2009 confirment ces résultats.
La culture prolongée en tant qu’outil de sélection embryonnaire permet aux patients d’arriver plus rapidement à la grossesse qu’avec la culture J2-J3, mais n’augmente pas les chances cumulées de grossesse. La culture prolongée des embryons surnuméraires pour la cryopréservation optimiserait le temps de prise en charge.
Intérêt du blastocyste en cas d’antécédent de grossesse extra-utérine
L’étude de Fang et al.(18) montre que le risque de grossesse extra-utérine est significativement moins important en cas de transfert au stade blastocyste comparé au transfert d’embryons clivés à J3. Ces résultats seraient probablement expliqués par la diminution de la contractilité utérine jusqu'à un statut presque quiescent au moment du transfert (Fanchin et al.(5) et au large diamètre du blastocyste (Schoolcraft et al.(19)). Elle met en évidence qu’un transfert de blastocystes congelés est associé à un taux de GEU significativement moins important qu’en cas de transfert de blastocyste frais.
Échecs répétés d’implantation et qualité embryonnaire des embryons clivés
L'étude de Karacan et al.(20) suggère que, chez les patientes, après échecs répétés d’implantation en AMP, il n’y aurait pas de bénéfice à transférer au stade blastocyste. Néanmoins, cette étude présente de nombreux biais. D'autres études avant elle avaient montré l'intérêt de transférer au stade blastocyste chez ces patientes ayant subi plusieurs échecs de tentatives de FIV.
L'étude rétrospective de Cruz et al.(21) montre une augmentation des taux d’implantations et de grossesses avec le transfert de blastocystes comparé au transfert d’embryon J3 chez les patientes ayant eu de multiples échecs de cycles de FIV. Guérif et al.(22) comparent le transfert de blastocystes au transfert d’embryons J2 chez des patientes qui avaient eu au moins 2 cycles de transfert. Il montre des taux d’implantations et de grossesses cliniques plus importants avec le transfert de blastocyste.
De même, chez les couples ayant eu des échecs antérieurs de FIV dus à l’absence d’embryons de bonne qualité, l’étude de Guérif et al. en 2011(7) montre l’intérêt de la culture prolongée chez ces couples. Retarder le transfert et laisser ces embryons en culture prolongée permet de sélectionner l’embryon à transférer et de transférer uniquement si formation de blastocyste.
Blastocyste et euploïdie
Bien que certains embryons génétiquement anormaux soient capables d’atteindre le stade blastocyste, le risque d’aneuploïdie d’un blastocyste de bonne qualité est moins important qu’un embryon clivé de bonne qualité. L’étude de Capalbo et al.(23) montre que seule la morphologie des blastocystes est prédictive du statut chromosomique de l’embryon, le taux d’euploïdie étant parallèlement corrélé à la qualité des blastocystes selon la classification de Gardner et Schoolcraft. Le diagnostic d’une aneuploïdie complexe (multiples anomalies chromosomiques) est associé à la morphologie des blastocystes. L’étude d’Alfarawati et al.(24) montre une corrélation entre la morphologie des blastocystes et l’aneuploïdie, ce qui suggèrerait un effet négatif de l’aneuploïdie sur le développement des blastocystes, sur la masse cellulaire interne et sur le trophectoderme. Les blastocystes de bas grade ont une incidence augmentée de monosomie et d’anomalies chromosomiques.
Une récente étude rétrospective de Gaurav Majumdar et al.(25) suggère que le taux d’euploïdie serait significativement plus important pour les blastocystes de bonne morphologie, et qu’il n’y aurait pas d’association entre la morphologie des embryons clivés et le taux d’euploïdie. De plus, il a été montré que les embryons qui avaient un développement plus lent et qui atteignaient le stade blastocyste à J6 avaient un taux d’euploïdie significativement plus bas que ceux qui avaient un développement plus rapide et qui atteignaient une expansion complète à J5. Le taux d’implantation est identique pour tous les blastocystes euploïdes, indépendamment de leur morphologie ou de leur jour de développement (J5 ou J6). Néanmoins, il existe une diminution des résultats avec les blastocystes en retard, c’est-à-dire ceux qui atteignent le stade blastocyste expansé au 6e jour post-fécondation. Cela pourrait être attribué à une perte de la synchronicité avec l’endomètre. La cryoconservation de ces blastocystes optimise alors leur potentiel implantatoire (Franasiak, 2013(26)). Gaurav montre aussi que le taux de FCS des blastocystes euploïdes est moins important que celui des embryons clivés euploïdes.
Au total, la morphologie des blastocystes est corrélée au taux d’euploïdie : meilleure est la qualité du blastocyste moins le risque d’aneuploïdie est important. De plus, le taux d’euploïdie des blastocystes J5 est significativement plus haut que celui des blastocystes J6.
Blastocystes et risque obstétrical et néonatal
Une métaanalyse de 6 études de 2014 (Dar et al.(27)) montre qu’en AMP, le risque d’accouchement prématuré (entre 32 et 37 SA) des grossesses uniques est significativement plus important après transfert de blastocystes comparé aux embryons clivés. Le risque d’anomalies congénitales est aussi plus élevé en cas de transfert de blastocystes. Aucune différence significative n'est observée pour les risques d’accouchement prématuré avant 32 SA et pour les petits poids de naissance.
En 2016, une métaanalyse de 12 études (Martins et al.(28)) a montré que les transferts de blastocystes sont associés à un risque plus élevé d’accouchement prématuré (< 37 SA et < 32 SA), de macrosomie fœtale et de mortalité périnatale, mais moins important d’hypotrophie fœtale.
Plus récemment, Wang et al.(29) confirme dans une métaanalyse de 12 études que le risque d’accouchement prématuré est plus important après transfert de blastocystes versus embryons clivés. Aucune différence dans le risque d’accouchement prématuré n’a été retrouvée pour les embryons congelés. Elle montre un risque augmenté de macrosomie fœtale après transfert de blastocystes et un risque augmenté d’hypotrophie fœtale ou RCIU après transfert d’embryons clivés.
Ces résultats restent cependant controversés, car d’autres études ne montrent aucune différence significative dans les risques obstétricaux ou néonataux (Oron et al.(30)). Il en est de même pour l’étude de Chambers et al.(31) en 2015 qui ne montre aucune différence pour les risques d’accouchement prématuré après transfert de blastocyste versus embryons clivés. Et pour l’étude rétrospective menée par Li et al.(32) qui ne retrouve, pour les grossesses uniques ou gémellaires, aucune différence significative dans les taux d’accouchement prématuré et dans les poids de naissance.
L'étude de Bouillon et al.(33) a déterminé s’il existait une relation entre la morphologie des blastocystes et les risques obtétricaux et périnataux. Elle montre qu’une morphologie de bas grade des blastocystes n’est pas corrélée aux principaux risques obstétricaux et néonataux.
En conclusion, la culture prolongée jusqu’au stade blastocyste permet une auto-sélection des embryons, de meilleurs taux de grossesse clinique et d’accouchement et permet le transfert des embryons dans des conditions plus naturelles. Cependant, le risque principal dû aux effets délétères de la culture est un échec de blastulation avec moins d’embryons exploitables (transfert et congélation).
Résultats
Aux regards des avantages et inconvénients de la culture prolongée, cette revue de la littérature permet de mettre en balance l’efficacité et le risque de cette technique dans le but d’adapter nos pratiques quotidiennes en AMP. Le transfert au stade blastocyste devrait donc être privilégié lors d’une politique d’eSET, en cas d’antécédents de grossesse extra-utérine et lors d'échecs répétés d'implantation et cela, en utilisant des moyens de culture optimale (milieu adapté et hypoxie, principalement). Sur le plan génétique, en l’absence d’autorisation actuelle en France de tests génétiques préimplantatoires, le transfert de blastocystes devrait être privilégié en cas de fausses couches à répétition ou chez les patientes plus âgées, du fait que seule la morphologie des blastocystes est corrélée au taux d’aneuploïdie. Les résultats des études menées sur les complications obstétricales et néonatales restent controversés. Les transferts de blastocystes seraient associés à un risque plus élevé d’accouchement prématuré, de macrosomie fœtale et de mortalité périnatale ; mais ces résultats n’ont pas été confirmés dans d’autres études.
Conclusion
La culture de l’embryon jusqu’au stade implantatoire est aujourd’hui bien connue. Une revue récente de Morris(34) montre qu’une équipe anglaise a permis la réalisation de la culture d’embryons humains jusqu’au stade de gastrulation, soit 14 jours après la fécondation ; cela montrerait que l’embryon humain possède des capacités intrinsèques d’organisation, sans avoir besoin de la participation de tissus maternels. Cette découverte va permettre une meilleure connaissance de la mise en place de ces stades précoces de développement embryonnaire dans le but de prédire le moment où les défauts de développement sont susceptibles de se produire et en conséquence de prévenir les fausses couches précoces. Ces résultats apporteront certainement de nouveaux défis éthiques pour la culture embryonnaire humaine.
Vidéo 1 : Blastocyste B4AA.
Vidéo 2 : Blastocyste en éclosion.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :