Urgences gynécologiques
Thérapeutique
Publié le 12 fév 2019Lecture 16 min
Ménométrorragies : l'imagerie utile
Benjamin FEDIDA, Centre médical des Pyramides, Maurepas
Les hémorragies génitales hautes ou ménométrorragies, sont secondaires à la présence d’une anomalie utérine, plus rarement annexielle, et sont un motif de consultation important en gynécologie.
Les 2 composantes anatomiques du corps utérin (endomètre et myomètre) sont le siège de multiples processus pathologiques à l’origine de saignements.
L’échographie pelvienne est l’examen de 1re intention. L’IRM pelvienne sera réalisée secondairement en fonction des résultats de l’échographie, voire de l’hystéroscopie.
Pathologie endométriale
Atrophie
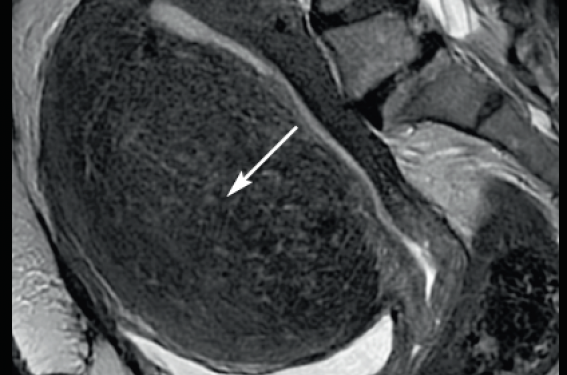
D’origine iatrogène ou due à une ménopause, l’endomètre est à peine visible de part et d’autre de la ligne cavitaire(1). Une épaisseur de l’endomètre < 5 mm amène à surseoir à l’hystéroscopie (figure 1). Celle-ci ne serait proposée qu’en cas de récidive des métrorragies. En dessous de ce seuil, le risque de cancer de l’endomètre chez une femme ménopausée présentant des métrorragies est inférieur à 1 %(1).
Figure 1 : Atrophie de l’endomètre. Coupe sagittale en échographie pelvienne par voie endovaginale. L’épaisseur de l’endomètre est fine, mesurée à moins de 5 mm (flèche).
Hypertrophie
En rapport avec une hyperestrogénie, le diagnostic est évoqué devant un épaississement de l’endomètre > 15 mm en période d’activité génitale et ≥ 5 mm chez la femme ménopausée avec ou sans traitement hormonal substitutif(2-5).
L’hyperplasie de l’endomètre (terme anatomopathologique) correspond à un développement exagéré en nombre et en densité des cellules glandulaires endométriales, allant de l’hyperplasie simple à l’hyperplasie atypique.
L’endomètre est hyperéchogène, homogène, ou siège de petites formations kystiques. L’interface endomètre-myomètre est régulière (figure 2)(5). Le Doppler couleur ou énergie permet d’éliminer un diagnostic différentiel, notamment avec la recherche d’un pédicule vasculaire du polype(6). Les éléments échographiques en faveur d’un cancer de l’endomètre sont(7) :
l’aspect hétérogène de l’endomètre avec des plages hypoéchogènes et des contours irréguliers ;
l’hypervascularisation endométriale est observée plus fréquemment dans les cancers (81 %) que dans les lésions bénignes (12 %), avec un enregistrement possible des flux artériels Doppler plus fréquents dans les cancers ;
l’évaluation de la régularité des contours externes contribue à l’appréciation de l’extension tumorale : une tumeur à contours réguliers est un élément en faveur de son caractère limité à la cavité utérine ; à l’inverse, des contours irréguliers ou l’amputation du myomètre sont en faveur d’une extension en profondeur(8).
Figure 2 : Hypertrophie de l’endomètre. Coupe sagittale en échographie pelvienne par voie endovaginale. Présence d’un épaississement homogène de l’endomètre à plus de 15 mm avec quelques images microkystiques (flèche).
L’hystéroscopie avec biopsies reste indispensable pour confirmer le diagnostic. L’IRM n’a a priori aucune indication dans cette pathologie bénigne sauf si l’hystéroscopie est impossible (sténose du col). Dans ce cas de figure très précis, une IRM pelvienne peut être proposée pour tenter de caractériser l’épaississement endométrial (figure 3). La séquence de diffusion permet de différencier les lésions bénignes de l’endomètre des tumeurs endométriales avec un cut off < 1,05.103 mm2/s pour les tumeurs (Se : 96 %, Sp : 95 %). L’infiltration myométriale et le caractère hétérogène de la tumeur sont également des arguments en faveur d’une origine maligne(8).
Figure 3 : Hypertrophie de l’endomètre. Coupe sagittale pondérée en TSE T2. Épaississement de l’endomètre en signal T2 intermédiaire, microkystique (flèche). (a) Coupes fines perpendiculaires au corps de l’utérus en diffusion. Pas d’anomalie de signal de l’endomètre (tête de flèche) avec un ADC mesuré à 1,5 (b).
Polypes
Ils sont constitués de glandes endométriales et de stroma et possèdent un pédicule vasculaire. Révélés par des ménométrorragies, ils sont plus fréquents entre 40 et 50 ans. Leur fréquence en postménopause est estimée à 16,3 % dont 43,6 % sont asymptomatiques(9,10).
L’échographie endovaginale montre typiquement une formation intracavitaire, bien limitée, hyperéchogène (figure 4).
Les polypes mesurent de 3 à 30 mm environ, sont pédiculés, pouvant alors s’engager vers l’isthme ou l’endocol. Ils élargissent la cavité utérine, refoulant localement sans l’interrompre la ligne cavitaire. Les plus volumineux restent hyperéchogènes et bien limités, mais contiennent très fréquemment des zones glandulaires kystiques. Parfois, le polype est ancien, calcifié.
L’IRM n’est pas recommandée. Néanmoins, il peut être utile de savoir identifier la nature d’une anomalie de la cavité utérine lors d’un bilan IRM demandé pour d’autres motifs. Le polype se traduit par une formation de signal T2, en règle moins élevé que l’endomètre sain, du fait d’une composante stromale plus importante, avec une plage en hyposignal T2 en cas de zones fibreuses ou de zones en hypersignal T2 s’il existe de petits kystes au sein du polype (figure 5). L’injection de gadolinium dynamique peut permettre de mettre en évidence le pédicule du polype avec son vaisseau central avec, sur les coupes plus tardives, une prise de contraste modérée, voire marquée. L’ADC (Apparent Diffusion Coefficient) est utile pour différencier un polype bénin (ADC > 10-3 mm2/s) d’un cancer (ADC < 10-3 mm2/s). Le léiomyome, qui présente un signal T2 nettement inférieur à celui de l’endomètre sain sur les séquences pondérées T2, est aisément identifié en IRM(8).
Figure 4 : Polype glandulo-kystique de l’endomètre. Coupe sagittale en échographie pelvienne par voie endovaginale. Épaississement microkystique de l’endomètre (flèche) avec pédicule vasculaire visible en doppler énergie.
Figure 5 : Polype glandulo-kystique de l’endomètre. Coupe sagittale pondérée en TSE T2 (a), coupe fine perpendiculaire au corps de l’utérus en diffusion, coupe sagittale T1 après injection de gadolinium (c). Lésion de l’endomètre en signal T2 intermédiaire (a), sans anomalie de signal en diffusion (b). L’interface endomètre-myomètre est régulier.
Endomètre sous tamoxifène
L’effet bénéfique du tamoxifène sur l’espérance de vie des femmes atteintes de cancer du sein est bien documenté. Le tamoxifène, parallèlement à ses effets antiestrogènes sur le tissu mammaire, a une action de type estrogène-like sur l’utérus.
Le tamoxifène est responsable en imagerie(11-13) :
d’un épaississement hyperéchogène microkystique de l’endomètre (figure 6). Sur le plan anatomopathologique, l’endomètre réalise l’aspect d’atrophie glandulo-kystique ; l’épaississement apparent de l’endomètre est la sommation de kystes glandulaires recouverts d’un épithélium mince non stratifié ;
du développement de polypes muqueux ;
du développement d’un cancer de l’endomètre. Ce risque serait multiplié par 1,6.
Figure 6 : Atrophie glandulo-kystique de l’endomètre sous tamoxifène. Coupe sagittale en échographie pelvienne par voie endovaginale. Pseudo-épaississement microkystique de l’endomètre (flèche).
Les signes échographiques persistent après l’arrêt du traitement, l’endomètre ne se renouvelant pas chez les patientes ménopausées.
Le tamoxifène a également un effet sur le myomètre avec une augmentation de la taille des myomes et une réactivation des foyers d’adénomyose. Les traitements par antiaromatase dans le cancer du sein n’entraînent, en revanche, pas d’effet sur l’utérus.
• Les ménométrorragies constituent le symptôme essentiel des pathologies endométriales.
• L’échographie endovaginale est réalisée en 1re intention, suivie en cas d’anomalie, d’une hystéroscopie avec biopsie.
• La présence d’une lésion tumorale impose une IRM pour optimiser l’approche thérapeutique.
Pathologie myométriale
Myomes
Les léiomyomes utérins sont les tumeurs utérines les plus fréquentes, présentes chez 20-30 % des femmes après 30 ans, plus fréquents chez les patientes de race noire et globalement présents sur 75 % des pièces d’hystérectomie(14).
Les myomes sont le plus souvent multiples (98 %), développés essentiellement dans le corps utérin. La présentation clinique des myomes est très variée : asymptomatique, saignements, douleurs, infertilité ou masse pelvienne palpable. Les ménorragies sont secondaires à la présence d’un myome sous-muqueux ou d’un utérus polymyomateux.
L’échographie pelvienne
C’est l’examen de première intention lors de la suspicion de myome utérin. En échographie, on visualise une structure arrondie à bords relativement réguliers bien limités, clairement différenciée du myomètre adjacent normal. L’échogénicité des myomes est variable en fonction de leurs remaniements, la majorité des myomes apparaissent hypoéchogènes, d’autres présentent une échostructure mixte plus ou moins hétérogène (figure 7). Le Doppler couleur ou énergie visualise la présence d’une vascularisation significative périphérique ou centrale des myomes.
Un nombre de myomes > 5, une grande taille des myomes > 3 cm, une position intermédiaire de l’utérus ou une obésité limitent de façon significative la qualité de l’examen.
Figure 7 : Utérus polymyomateux en échographie par voie endovaginale. Coupe échographique endovaginale en mode 2D visualisant un utérus de contours bosselés (têtes de flèches), présentant plusieurs masses circonscrites grossièrement arrondies hypoéchogènes par rapport au myomètre sain résiduel correspondant à de banals myomes multiples interstitiels de types 3 et 4 (flèches).
En IRM
Un léiomyome utérin banal présente un hyposignal T2 significatif comparé au signal du myomètre externe adjacent normal et un isosignal T1 peu spécifique (figure 8)(15-17). L’imagerie fonctionnelle ne présente pas d’intérêt pour les myomes utérins banals avec un hyposignal en diffusion et une courbe de rehaussement de type 2, souvent calquée sur celle du myomètre normal en conservant l’aspect sous-décalé. Les clichés tardifs en T1 après injection de gadolinium montrent une prise de contraste plus ou moins homogène du myome discrètement hypo-intense ou iso-intense par rapport au myomètre adjacent.
Figure 8 : IRM d’un utérus polymyomateux. Séquence IRM en coupes sagittales pondérées en T2 (a), en T1 (b) et diffusion en b1 400 (c) visualisant un volumineux utérus de contours bosselés, siège de multiples myomes en hyposignal T2 et diffusion, et isosignal T1.
La topographie des myomes
Elle doit être précisée afin d’adapter au mieux la prise en charge thérapeutique. Il parait nécessaire d’utiliser la nouvelle classification FIGO des léiomyomes également utilisée par les gynécologues (figure 9)(19).
Les myomes interstitiels (« types 3 et 4 ») développés dans le myomètre de façon exclusive sont les plus fréquents. Le myome de « type 4 » est circonscrit par du myomètre résiduel normal alors que le myome de « type 3 » affleure en dedans la muqueuse endométriale sans effet de masse surajouté.
Les myomes intracavitaires (« types 0, 1 et 2 ») se développent à partir du myomètre mais présentent une composante intracavitaire plus ou moins développée refoulant la muqueuse endométriale. La classification FIGO différencie les myomes « type 0 » totalement intracavitaires ayant une base d’implantation large ou pédiculée. Les myomes « type 1 » et « type 2 » présentent respectivement une composante intracavitaire > 50 % et < 50 %.
Les myomes sous-séreux se développent à partir du myomètre, mais présentent une composante extra-utérine plus ou moins développée. La classification FIGO différencie les myomes présentant une composante extra-utérine respective < 50 %, > 50 % et de 100 % comme étant de « type 5, 6 et 7 », respectivement.
Figure 9 : Schéma de la topographie des léiomyomes utérins avec classification selon la Fédération internationale de gynécologie et d’obstétrique (FIGO) : les myomes corporéaux sont sous-muqueux (0, 1, 2), interstitiels (3, 4), transmuraux (2-5), et sous-séreux (5, 6, 7). Les myomes sans lien direct avec le myomètre sont de type 8.
Les myomes remaniés
Il est très difficile de caractériser les myomes en échographie-Doppler. C’est l’IRM qui va permettre de suggérer la présence de remaniements éventuels(14,16,17).
La fibrose hyaline est le remaniement présent dans la plupart des myomes banals à l’origine de leur hyposignal T2 franc avec isosignal T1.
Le remaniement œdémateux diffus ou focal (50 %) est responsable d’un signal intermédiaire du myome en pondération T2 et en T1. L’imagerie fonctionnelle est utile pour différencier un myome œdémateux d’un myome cellulaire, ceci étant déterminant pour la prise en charge. Ainsi, la valeur calculée de l’ADC moyen au sein d’un myome en hypersignal diffusion en b1000 est significativement supérieure (> 1,6 10-3 mm2/s) à celle d’un myome cellulaire.
Les myomes en dégénérescence kystique sont rares puisqu’ils représentent environ 4 % des myomes.
La nécrobiose d’un myome est secondaire à l’obstruction des vaisseaux en périphérie du myome. Celle-ci est favorisée par la grossesse ou la prise de contraceptifs oraux. Contrairement aux autres remaniements, la dégénérescence hémorragique est symptomatique, responsable de phénomènes douloureux aigus. La présentation en IRM est classique avec un hypersignal en pondération T1 et un hyposignal T2, correspondant à la thrombose des veines périphériques du myome.
Myomes atypiques
Les sous-types de léiomyomes ont des caractéristiques histologiques spécifiques devant être différenciées d’un éventuel léiomyosarcome. Ces myomes sont classés en cellulaire, cellulaire hémorragique, épithélioïde, myxoïde, lipomateux, mitotiquement actif, atypique ou vasculaire. La très grande majorité de ces myomes spécifiques sont bénins, rarement de pronostics incertains et exceptionnellement malins.
L’intérêt de l’imagerie est d’alerter le chirurgien sur le caractère atypique d’un myome(15-17).
Léiomyome cellulaire
Il représente le sous-type histologique le plus fréquemment rencontré.
Histologiquement, il est défini par un accroissement du nombre de cellules par unité en comparaison du myomètre adjacent et de la majorité des myomes.
En IRM, sur les séquences morphologiques, il présente un signal T2 intermédiaire globalement homogène par rapport au myomètre adjacent, associé à un isosignal T1. Sur les séquences de diffusion, il existe un hypersignal sur les valeurs de b élevées (b ≥ 1 000 mm/sec2) associé à un abaissement du coefficient d’ADC pour les myomes cellulaires contrairement aux myomes œdémateux. Des travaux préliminaires semblent suggérer que la valeur moyenne d’ADC des myomes cellulaires (1,18 x 10-3 mm2/sec) comparativement aux myomes œdémateux (1,610-3 mm2/sec) est significativement différente aidant au diagnostic différentiel (figure 10).
Figure 10 : Léiomyome cellulaire bénin en imagerie par résonance magnétique (IRM). Coupes IRM sagittales pondérées T2 (a), diffusion avec b 1 200 (b), T1 avec suppression de graisse et injection de gadolinium visualisant un léiomyome de type 3-5 (flèches) en signal intermédiaire hétérogène en T2, hypersignal en diffusion et valeurs du coefficient de diffusion apparente (ADC) entre 1,26 à 1,5 10-3 mm2/sec en rapport avec un léiomyome cellulaire.
Léiomyosarcome
Le léiomyosarcome est une tumeur rare qui représente 1,3 % des tumeurs malignes de l’utérus.
Les critères histologiques qui conduisent au diagnostic sont la conjonction d’une cellularité élevée, de nombreuses mitoses, et d’atypies cytonucléaires.
Ils présentent des limites irrégulières, avec un signal T2 intermédiaire, un contenu hémorragique en hypersignal T1 et nécrotique(18).
Les séquences de diffusion sont donc essentielles, elles retrouvent un hypersignal sur les valeurs de b élevées (b ≥ 1 000 mm/s2) associé à un abaissement du coefficient d’ADC (figure 11). Cependant, il n’existe pas de consensus pour définir une valeur-seuil permettant de différencier formellement myome cellulaire et léiomyosarcome, ce qui rend souhaitable d’associer tous les critères. Certains auteurs retrouvent un chevauchement des valeurs d’ADC, d’autres un ADC significativement plus bas pour les léiomyosarcomes versus myomes cellulaires (ADC moyen : 0,79 10-3 mm2/s versus 1,18 10-3 mm2/s).
Figure 11 : Léiomyosarcome utérin en imagerie par résonance magnétique (IRM). Coupes IRM sagittales pondérées en T2 (a), diffusion à b1 200 (b) et T1 après injection de gadolinium et suppression de graisse (c) visualisant une masse (flèches) tumorale envahissant le myomètre antérieur. Cette masse présente un signal excessivement hétérogène avec large plage tissulaire en signal intermédiaire en T2 (flèche), hypersignal diffusion avec un ADC mesuré à 0,7 10−3 mm2/sec en rapport avec un léiomyosarcome du corps utérin de haut grade.
Critères de suspicion d’une lésion myométriale :
– contours irréguliers,
– signal T2 intermédiaire,
– hétérogène,
– remaniements hémorragiques,
– ADC < 1,23.
Adénomyose
L’adénomyose est excessivement fréquente ; certaines études ont permis de proposer des chiffres de prévalence de la maladie entre 30-47 %.
Deux tiers des patientes sont symptomatiques, présentant des douleurs pelviennes, une dysménorrhée et des ménométrorragies. Cette symptomatologie est non spécifique, pouvant être retrouvée dans les saignements d’origine fonctionnelle, et surtout dans les léiomyomes.
L’âge, la gestité, la parité, les prélèvements endométriaux, des curetages itératifs, la prise de DES ou l’endométriose sous-péritonéale sont des facteurs étiopathogéniques associés de façon significative à l’adénomyose.
L’adénomyose est caractérisée par la présence de muqueuse endométriale hétérotopique au sein du myomètre, entourée par une hypertrophie et une hyperplasie musculaire lisse secondaire surajoutée.
Les deux formes d’adénomyose les plus fréquentes sont(20) :
L’adénomyose diffuse, la plus fréquente, correspond à une atteinte d’au moins un secteur myométrial (fond, antérieur, postérieur, droit, gauche). Cette atteinte peut être asymétrique ou globale. En fonction de son extension en profondeur on différencie l’atteinte superficielle qui est limitée au tiers interne du myomètre et l’atteinte profonde qui s’étend jusqu’à l’arcade vasculaire (deux tiers internes) respectant une collerette de myomètre périphérique.
L’adénomyome correspond à une forme nodulaire ; c’est pourquoi à l’examen anatomopathologique macroscopique, il est difficile à différencier d’un authentique léiomyome. Son siège électif se situe autour des cornes utérines et peut être multiple et/ou associé à une adénomyose diffuse.
L’adénomyome peut parfois se kystiser présentant une cavité centrale supracentimétrique à contenu hémorragique.
Par ailleurs, il est important de différencier 2 types d’adénomyoses dénommées interne et externe. L’adénomyose interne correspond à l’adénomyose diffuse décrite précédemment. L’adénomyose externe correspond à une colonisation du myomètre de dehors en dedans à partir d’une atteinte endométriosique péritonéale extensive. Elle est caractérisée par une hyperplasie musculaire accompagnée d’une fibrose entourant le tissu endométrial ectopique.
L’imagerie (échographie et IRM) fait le diagnostic d’adénomyose de façon facile et fiable permettant aux cliniciens une prise en charge thérapeutique optimale.
Échographie et adénomyose
L’échographie endovaginale est la technique de référence pour affirmer une adénomyose(21) (figure 12).
Les petites lacunes anéchogènes (2 à 9 mm) intramyométriales souvent proches de l’interface endomètre-myomètre sont le signe le plus spécifique (98 %) mais peu sensible (50-65 %). Ce signe traduit la présence de foyers endométriaux ectopiques au sein du muscle utérin. Le Doppler couleur permet de différencier ces lacunes de structures vasculaires. Les nodules hyperéchogènes, les stries linéaires hyperéchogènes juxta-endométriales donnant un aspect nodulaire ou irrégulier de l’interface endomètre-myomètre sont aussi des arguments échographiques en faveur de tissus endométriaux ectopiques.
Les critères échographiques secondaires au développement de l’hyperplasie musculaire sont l’hétérogénéité myométriale, les stries linéaires hypoéchogènes et l’augmentation de volume de l’utérus le plus souvent asymétrique. L’hétérogénéité myométriale est le signe le plus utilisé pour le diagnostic d’adénomyose. Cependant, il est peu spécifique (30-65 %). Le Doppler énergie permet de différencier adénomyose diffuse et myomes. En effet, l’adénomyose présente une vascularisation radiaire, contrairement aux myomes qui présentent une vascularisation périphérique circonférentielle(22).
Figure 12 : Association des signes d’adénomyose en échographie endovaginale et imagerie par résonance magnétique (IRM). Coupes échographiques en mode 2D (a) visualisant l’hypertrophie asymétrique du myomètre, l’aspect globuleux régulier contenant des images kystiques myométriales (flèche) associées à une hétérogénéité myométriale mal limitée avec une vascularisation radiaire (tête de flèche) en Doppler énergie (b). Séquences IRM Fast Spin Echo (FSE) en mode 2D T2 sagittale (c) visualisant une multitude de spots hyperintenses majoritairement localisés dans toute l’épaisseur du myomètre postérieur (flèche) en rapport avec une adénomyose interne diffuse profonde asymétrique.
IRM et adénomyose
L’IRM est toujours un examen de seconde intention après l’échographie pelvienne(23-25) (figure 13).
– L’épaisseur de la zone jonctionnelle est le critère le plus communément utilisé ; il correspond histologiquement à l’hypertrophie musculaire. Un seuil ≥ 12 mm était associé à des sensibilité, spécificité et valeurs prédictives positive et négative de 0,93, 0,91, 0,79 et 0,98.
Le premier évaluant le ratio ZJmax/myomètre total, un ratio ≥ 40 % était associé à des sensibilités, spécificités et valeurs prédictives positive et négative de 0,65, 0,93, 0,81 et 0,84.
Ces critères pris isolément ne sont pas nécessaires et suffisants pour poser le diagnostic d’adénomyose.
– Les spots en hypersignal T2 sont le seul critère pathognomonique, peu sensible cependant. Ces spots sont le plus souvent visibles en juxta-endométrial et plus rarement en profondeur du muscle utérin.
– La présence de spots hémorragiques est beaucoup moins fréquente et le taux de détection sur les séquences pondérées T1 est faible.
C’est l’association de ces divers critères qui permet à l’IRM d’être une technique de référence pour ce diagnostic.
Figure 13 : Spots myométriaux hyperintenses en imagerie par résonance magnétique (IRM). Séquences IRM Fast Spin Echo (FSE) en mode 2D T2 sagittale (a), axiale (b) et coronale (c), visualisant une multitude de spots hyperintenses majoritairement localisés dans toute l’épaisseur du myomètre (flèches) en rapport avec une adénomyose interne diffuse profonde.
Critères diagnostiques IRM d’adénomyose :
– épaississement de la zone jonctionnelle > 12 mm,
– rapport ZJmax/myomètre total > 40 %,
– spots kystiques et/ou hémorragiques.
Conclusion
Après l’examen clinique et les prélèvements biologiques éventuels, l’échographie endovaginale est l’examen de première intention dans la démarche étiologique de saignements gynécologiques anormaux.L’IRM complète le bilan étiologique des formes complexes et/ou de diagnostic difficile.
Références disponibles sur simple demande à biblio@len-medical.fr
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :